Saúde & Bem-estar
Doenças genéticas na raça Quarto de Milha

Ao longo da história da raça Quarto de Milha foram identificadas algumas doenças genéticas que a afetaram
A relação entre cavalos e humanos remete a aproximadamente 5500 anos de história de domesticação desses animais. Nesse espaço temporal os criadores foram realizando cruzamentos e selecionando os aspectos mais desejados. Essa seleção artificial baseada em características desejadas contribuiu para o número de raças existentes – 570 espalhadas pelo globo terrestre, adaptadas aos mais variados climas.
Uma das raças que surgiu a partir de cruzamentos na busca por características desejáveis como tração, velocidade e beleza, juntamente com o processo de colonização e desenvolvimento da humanidade – especificamente nos Estados Unidos é a raça Quarto de Milha. Entretanto a busca por características desejáveis por meio de cruzamentos também conduz a propagação de características indesejáveis.
Ao longo da história da raça Quarto de Milha foram identificadas algumas doenças genéticas que a afetaram. Sobretudo, difundidas amplamente entre os criadores por meio de cruzamentos ou inseminações. Doenças genéticas surgem por mutações no DNA causadas por fatores ambientais (agentes físicos, químicos ou biológicos) ou, podem ocorrer naturalmente durante a formação das células reprodutoras – espermatozoides e óvulos.
Em equinos já foram descritas 102 doenças geneticamente transmissíveis sendo que seis dessas doenças merecem destaque na raça Quarta de Milha: Paralisia Periódica Hipercalêmica (HYPP); Astenia Dérmica Regional Hereditária Equina (HERDA); Miopatia de Estoque de Polissacarídeo – 1 (PSSM-1); Deficiência da Enzima Ramificadora de Glicogênio (GBED); Hipertermia Maligna (HM) e Miosite Imunomediada (IMM),as quais compõem o chamado 6 Panel.
HYPP
É uma doença genética autossômica codominante decorrente de mutação no gene SCN4A. Assim, descrita em várias raças de cavalos inclusive em Quarto de Milha a doença não tem predisposição por sexo ou idade. Ficou conhecida e difundida a partir do garanhão Impressive, o qual produziu aproximadamente 2250 filhos.
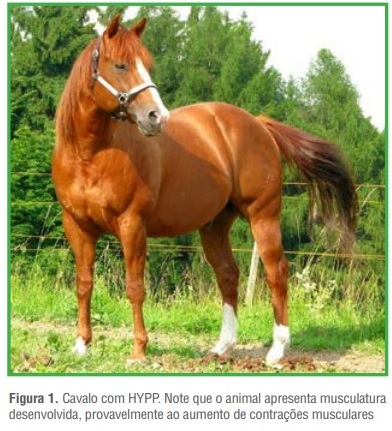
Os sinais clínicos ocorrem em forma de crises, podendo se manifestar por fasciculações musculares (Figura 1), miotonia, prolapso de terceira pálpebra, fraqueza muscular, dificuldade respiratória, decúbito. Durante uma crise pode ocorrer morte súbita devido à insuficiência cardíaca e paralisia dos músculos respiratórios.
Determinadas situações em que o animal é exposto ao estresse como baixas temperaturas, transporte e jejum prolongado podem desencadear essas crises. A principal alteração sérica que pode ser identificada nos equinos com a doença é a elevação dos níveis de potássio. Animais homozigotos podem apresentar crises diárias e são mais afetados do que animais heterozigotos, os quais podem ser assintomáticos.
HERDA
É um distúrbio hereditário autossômico recessivo decorrente da mutação do gene PPIB que afeta a formação da fibra do colágeno, tornando-a mais fraca e desorganizada.
Cavalos homozigotos (afetados) para a mutação no gene demonstram, sobretudo, normalidade ao nascimento. Mas entre os primeiros dois nos de vida, esses animais geralmente desenvolvem uma pele frágil, elástica e hiperextensível capaz de dilacerar e formar cicatrizes, úlceras e massas tumorais, sendo esses os principais sinais clínicos da doença (Figura 2).
As feridas são de difícil cicatrização resultando em deformações na pele do animal. Essas lesões cutâneas predominam no dorso, mas podem ocorrer em qualquer parte do corpo do animal.

PSSM-1
Considerada a principal miopatia (doença muscular) que afeta a raça Quarto de Milha foi descrita em 1992. De caráter dominante autossômico, resulta da mutação no gene GYS1, responsável por codificar a enzima glicogênio sintase que atua na produção do polissacarídeo glicogênio (polissacarídeo formado por N moléculas de glicose, usado para armazenar energia nas células).
Dessa forma, como a digestão do glicogênio não ocorre normalmente, essa mutação faz com que ocorra o acúmulo desse polissacarídeo nas células musculares, esqueléticas e cardíacas. Esse acúmulo de glicogênio faz com que ocorram lesões nas fibras musculares causando disfunção muscular. Sendo que os principais músculos afetados são da garupa, coxa e músculos das costas, incluindo o glúteo, semimembranoso e semitendinoso.
A doença não apresenta, portanto, predisposição a sexo e os principais sinais clínicos da PSSM1 são andar rígido, relutância em se movimentar, rigidez, fraqueza e dor muscular. Animais afetados podem ter os sintomas minimizados a partir de uma dieta com menos carboidratos.
GBED
A saber, é uma doença hereditária autossômica monogênica recessiva fatal, causada por uma mutação pontual no gene GBE1 responsável por codificar a Enzima Ramificadora de Glicogênio (GBE). Devido a essa mutação os tecidos dos potros homozigotos recessivos são incapazes de sintetizar glicogênio ramificado, pois essa enzima GBE é importante para a glicogênese.
Os tecidos do músculo cardíaco, pelve renal e o cérebro são incapazes de armazenar energia suficiente para seu funcionamento. Pode levar a abortos, natimortos e nascimentos de potros fracos. Esses últimos, podendo apresentar deformidades flexurais, convulsões, dificuldades ou incapacidade de permanecer em estação, ausência do reflexo de sucção. e também sinais de insuficiência cardíaca e respiratória e morte súbita nas primeiras horas de vida.
HM
Decorrente de mutação no gene RyR1 é uma doença de caráter dominante e resulta em acúmulo de cálcio nas células musculares. Animais que apresentam essa mutação quando expostos a medicamentos como anestésicos ou relaxantes e atividades físicas intensas, apresentam o acúmulo de cálcio nas células musculares resultando em aumento do metabolismo e contrações musculares.
Esse estado hipermetabólico aumenta a produção de calor fazendo com que o animal entre em hipoxemia, acidose metabólica e apresente um rápido aumento da temperatura corporal, que pode ser fatal se não reconhecida e tratada precocemente.
IMM
Essa doença teve sua mutação identificada no gene MYH1 em uma pesquisa recente sendo também conhecida como Miopatia MYH1. Esta mutação tem caráter semi-dominante, o que significa que animais que tem uma cópia da mutação estão em risco de desenvolver a doença, e animais com duas cópias apresentam por sua vez um risco muito maior de desenvolvê-la.
Além disso, apresenta penetrância incompleta, ou seja, apenas ter a mutação não significa que o animal desenvolverá a doença, mas sim que ele está sob maior risco, sendo necessário algum gatilho para que apresente os sinais. O gene mutado leva a uma produção defeituosa de uma proteína presente em células de contração rápida, abundantes no dorso e garupa destes animais.
Quando o sistema imune é desafiado seja por uma infecção, uma doença ou até mesmo por outra causa desconhecida, este reconhece essas proteínas defeituosas e as atacam. Causam, assim, uma severa perda de massa muscular, característica da manifestação aguda da doença. Acima de tudo, o animal pode recuperar a musculatura após vários meses, recebendo tratamento adequado.
Alguns animais, ao invés de apresentarem episódios de perda muscular aguda, podem manifestar episódios de rabdomiólise não associados a exercício ou esforço.

Mais detalhes das doenças geneticamente transmissíveis na raça Quarto de Milha
Todas as doenças do 6 Panel são de caráter autossômico. Isso significa que as mutações que causam essas doenças não se encontram nos cromossomos sexuais X e Y. Antes de mais nada, uma questão muito importante é conhecer se a doença comporta-se como recessiva ou dominante.
Essas informações são de extrema importância para a reprodução dos animais, pois permitirá ao responsável fazer cruzamentos adequados e evitar a disseminação do gene mutado por meio de cruzamentos inadequados.
Se a doença é de caráter dominante é necessário que o animal tenha herdado apenas uma cópia do alelo mutado de um dos reprodutores para que a doença se manifeste, pois esse prevalece sobre o alelo recessivo. Nesse caso o animal é denominado como heterozigoto e 50% de suas células reprodutoras carregarão um alelo mutado.
Se o animal for homozigoto afetado 100% das células reprodutoras apresentarão uma cópia do alelo mutado. Para doenças de caráter recessivo é necessário que o animal tenha herdado duas cópias do alelo mutado para que a doença se manifeste. Nesse caso o animal precisa ser homozigoto.
Exemplos
Para exemplificar um cruzamento a partir da genotipagem dos animais, considere o seguinte caso: cruzamento de garanhão heterozigoto para HERDA X égua livre para HERDA
Cada animal carrega duas cópias para cada gene – 1 de origem materna e 1 de origem paterna. HERDA é uma doença recessiva que para se manifestar precisa de duas cópias do gene mutado. No exemplo o garanhão carrega uma cópia do gene mutado (HERDA/n) e a égua não carrega mutação – (n/n) (Figura 3).

Nesse exemplo o criador tem uma probabilidade 50% de obter uma prole livre da mutação e uma probabilidade de 50% para obter uma prole portadora da mutação, apesar de não manifestar a doença. Portanto, faz-se necessário genotipar a prole para saber quem carrega a mutação para fazer cruzamentos confiáveis.
Considere um segundo caso: cruzamento de garanhão livre para PSSM-1 X égua heterozigotapara PSSM-1 (Figura 4).
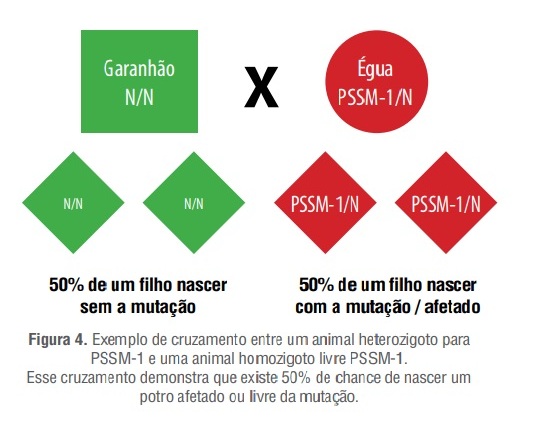
O resultado desse cruzamento demonstra que no caso de uma doença dominante há probabilidade de 50% de gerar uma prole com a doença e 50% de gerar uma prole livre da mutação.
Diagnóstico genético
Cada uma das doenças geneticamente transmissíveis que fazem parte do 6 Panel é causada por uma mutação específica que atinge os genes supracitados. Com o advento da biotecnologia atualmente é possível de forma rápida e confiável sequenciar o trecho do DNA onde se encontra a mutação de interesse e analisá-la.
Desse modo, é necessário utilizar o DNA do animal para o qual se pretende identificar alguma mutação, sendo que o DNA é extraído de amostra de sangue ou bulbo de pelos da crina. A opção pelo diagnóstico genético permite ao proprietário saber o genótipo do animal e quais os possíveis cruzamentos poderão ser realizados.
Após a realização dos exames para doenças geneticamente transmissíveis, o animal será identificado como livre – sem mutação; portador – apresenta uma cópia da mutação, ou afetado– apresenta a doença.
Os animais afetados ou portadores de uma cópia do gene mutado podem transmitir esses genes alterados para a prole causando uma difusão da mutação no plantel. Como a difusão da mutação que causa a doença não é desejável aconselha-se a não utilizar o animal como matriz reprodutiva.
Outra consequência para os animais afetados é a própria manifestação da doença, causando dores, desconforto e até a morte, ou ainda a indisponibilidade do uso para práticas esportivas.
Conclusão
Qual é a vantagem para os criadores e proprietários de cavalos da raça Quarto de Milha genotiparem suas matrizes ou prole? Em primeiro lugar é a certeza de que suas matrizes estão livres ou não de mutações que causam alguma doença do 6 Panel.
Em segundo lugar, caso encontre mutações nas matrizes é possível montar um perfil do plantel e genotipar os animais com o intuito de identificar os que carregam a mutação, tornando possível assim realizar um cruzamento consciente, com informação e evitando a disseminação da doença.
O Laboratório Centervet conta coma tecnologia necessária. Ao mesmo tempo em que tem profissionais capacitados para orientar os criadores e proprietários de cavalos Quarto de Milha quanto as doenças do 6 Panel.
Além desses exames, o laboratório oferece serviço para outras doenças genéticas de cavalos como a Síndrome do Potro Branco Letal, testes de homozigose para características de interesse como pelagem. Esse último, incluindo Tobiano, Oveiro, Splash SW1, SW2 e SW3, Red/Black Factor, entre outros. Assim como para doenças geneticamente transmissíveis em cães, testes de paternidade em cães, PCRs para grandes aniamais e animais pets,e em fase de credenciamentopara paternidadeequina e bovina.
Por Cleiton Silva Marques – Biólogo; Bruna T. Ibiapina – Médica Veterinária; Gabrieli C. Modolo – Médica Veterinária
Fonte: Center Vet – Laboratório de Patologia Clínica Veterinária
Crédito da foto de chamada: Divulgação/Charles Wernie
INFORME PUBLICITÁRIO
Veja mais artigos de Saúde Animal no portal Cavalus













You must be logged in to post a comment Login